Átomo
El diccionario de la Real Academia Española ubica la etimología del término átomo en el vocablo griego átomon y en el latín atŏmus, que significan «que no se puede cortar» o «indivisible». A su vez, en su primera acepción lo ubica como un término proveniente de la física y la química, y lo define como una «partícula indivisible por métodos químicos, formada por un núcleo rodeado de electrones». A esta definición inicial se suman las dos siguientes acepciones disponibles: «partícula material de pequeñez extremada» y «parte muy pequeña de algo».
Por su imposibilidad de ser dividido a través de procesos químicos, el átomo también es conocido como la «partícula fundamental». Los avances en el descubrimiento y descripción de los átomos surgieron principalmente de áreas como la física y la química. Sin embargo, fue Demócrito, filósofo y matemático proveniente de la ciudad de Abdera en Grecia, el primero en acuñar la palabra átomo para referirse a la partícula mínima de la materia, aquella que no puede ser dividida sin perder sus propiedades químicas.
Más adelante, entre 1803 y 1807, el científico británico John Dalton fue el primero en proponer lo que se conoce como Modelo Atómico de Dalton, en el que se recogen una serie de postulados para explicar el comportamiento de los átomos. Los aportes teóricos de Dalton describen en sus postulados una serie de aspectos significativos que permitieron comprender las características básicas de los átomos, a saber: 1) la materia está formada por una serie de pequeñas partículas llamadas átomos, que son indivisibles e indestructibles; 2) los átomos de un mismo elemento son iguales entre sí, en cuanto a su masa y a sus propiedades; 3) la combinación de los átomos permiten la formación de compuestos que tienen relaciones simples de números enteros y pequeños; 4) es posible combinar átomos de diferentes elementos en proporciones distintas para formar más de un compuesto; 5) los compuestos químicos pueden formarse mediante la unión de los átomos de dos o más elementos.
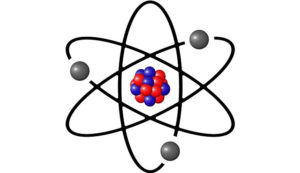
Al modelo propuesto por Dalton luego se sumaron los trabajos de los científicos Joseph John Thomson, Hantaro Nagaoka, Ernest Rutherford, Niels Bohr, Arnold Sommerfeld, Erwin Schrödinger y Paul Dirac, que han resultado en incontables refutaciones, propuestas teóricas y aportes científicos en esta materia. Precisamente, la imagen más conocida para la representación gráfica del átomo es producto del modelo atómico propuesto por Niels Bohr, según el cual los protones y neutrones se encuentran agrupados en el centro del átomo, mientras que los electrones orbitan alrededor de ellos.
¿Cómo está compuesto un átomo?
Un átomo está dividido en dos partes: el núcleo, que representa la parte central del átomo y que incluye a los protones y neutrones, y la corteza, que constituye —como su nombre lo indica— la parte externa del átomo, donde es posible encontrar los electrones. Estas tres partículas subatómicas (protones, neutrones y electrones) forman la estructura del átomo y permiten la diferenciación de los átomos por las múltiples posibilidades de relación entre ellas.
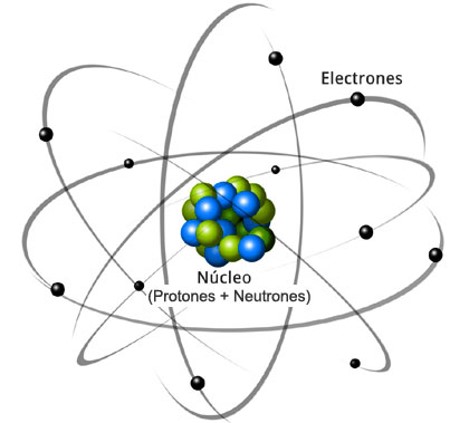
Composición de un átomo
Protones
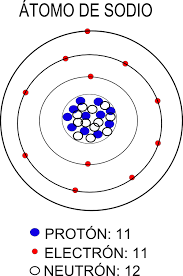
Los protones, que fueron descubiertos en 1891 por el científico Ernest Rutherford, son partículas que tienen una carga positiva y que definen el elemento químico al que pertenece y el número atómico, esto último a partir de la cantidad de protones disponibles en el núcleo. De esta manera, es posible encontrar en la Tabla periódica de los elementos químicos que el número atómico del sodio —representado con el símbolo Na— es 11, lo que indica que un átomo de sodio tiene 11 protones y que, de la misma forma, cualquier átomo con 11 protones es un átomo de sodio.
En un átomo estable se encuentra la existencia de un electrón orbitando alrededor un protón. Debido a que los protones y los electrones tienen una carga con valor absoluto igual, pero opuesto (uno es negativo y el otro positivo), la fuerza electromagnética provoca que los electrones siempre estén unidos en torno al núcleo.
Neutrones
Los neutrones, por su parte, tienen una carga eléctrica neutra proveniente de tres partículas —conocidas como quarks—, cuya sumatoria de cargas dan 0 como resultado. Fueron descubiertos en 1932 por el reconocido físico inglés James Chadwick, aunque ya desde 1920, Ernest Rutherford y otros científicos de la época habían propuesto la existencia de esta partícula subatómica en la estructura del átomo.
Además de ser partículas con carga neutra, la cantidad de neutrones son constantes cuando están agrupados en un núcleo estable, pero inestables y con una vida promedio de unos 15 minutos cuando están fuera del núcleo atómico; de allí que al salir del núcleo se convierten en «neutrones libres» que se desintegran y transforman en protones, electrones y antineutrones, estos últimos no son más que una partícula opuesta al neutrón.
Juntos, el protón y el neutrón son conocidos como nucleones, puesto que combinados forman una misma partícula en el núcleo de los átomos. De esta manera, el número másico, también presente en la Tabla periódica de los elementos químicos y representado con la letra A, indica la sumatoria de la cantidad de protones y neutrones de cada elemento.
Electrones
En lo que respecta a los electrones, única partícula subatómica presente en la corteza del átomo, son los que aportan la carga negativa. Su nombre proviene del vocablo del griego antiguo ḗlektron, que significa «ámbar». El antecedente más remoto sobre el descubrimiento de los electrones posiblemente se remonta a los antiguos griegos, pero es en el tratado De Magnete, elaborado por el científico inglés William Gilbert en 1600, cuando se reporta de la existencia de la propiedad de un objeto de atraer a otros más pequeños luego de que se frota. Sin embargo, al físico británico Joseph John Thomson es a quien se le atribuye comúnmente el descubrimiento del electrón a partir de sus importantes experimentos.
La carga de un electrón es igual, pero en sentido opuesto a la de un protón, que es la partícula contiene la carga positiva del átomo. Debido a su polaridad negativa, a cada neutrón se le considera una unidad de carga eléctrica. El descubrimiento de los electrones dio inicio a una nueva etapa de la física y los experimentos en esta materia constituyeron una de las primeras experiencias de los seres humanos en torno a la electricidad.
¡Por cierto! Antes de que te vayas, queremos recomendarte esto que seguro que te interesa:
- Aparato Reproductor Masculino
- Terremoto de México de 1985
- La Entrevista
- La Argumentación
- Racionalismo
- Ivermectina
- Prehistoria
- Huracán Patricia
- Animales Carnívoros
Son una serie de contenidos a parte del que has leído que puede ser interesante para tí ¡Muchas gracias por leernos!