Modelo de Bohr
Luego del modelo atómico propuesto por John Dalton, entre 1803 y 1807, el físico Niels Bohr propuso un modelo para explicar el comportamiento de la estructura de los átomos. El modelo atómico de Bohr —propuesto en 1913— tuvo como base las teorías de su maestro Ernest Rutherford, a quien se le atribuye, entre otras cosas, el descubrimiento de los protones en 1891 y la creación de su propio modelo. La influencia de los postulados de Rutherford en el modelo de Bohr ha implicado que a este modelo también se le conozca con los apellidos de ambos.
El científico Niels Bohr nació en Copenhague, capital de Dinamarca, el 7 de octubre de 1885. Luego de recibir su doctorado en la Universidad de Copenhague en 1911, quiso continuar sus estudios en el Laboratorio de Cavendish en Cambridge, donde tuvo como mentor a Ernest Rutherford. Sin embargo, fue en Mánchester donde logró culminar sus estudios, contando aún con la mentoría de Rutherford. Entre sus logros estuvo la creación del Instituto Nórdico de Física Teórica, que dirigió mientras ejercía como profesor de física teórica en la Universidad de Copenhague, y la postulación de su propio modelo atómico.

Niels Bohr
Debido a su forma, al modelo de Bohr se le compara con el propuesto por Copérnico para explicar el movimiento de los planetas alrededor del sol; pero gracias a sus trascendentales postulados y experimentos científicos en torno a la estructura de los átomos y la radiación electromagnética, en 1922 le fue conferido a Bohr el Premio Nobel de Física.
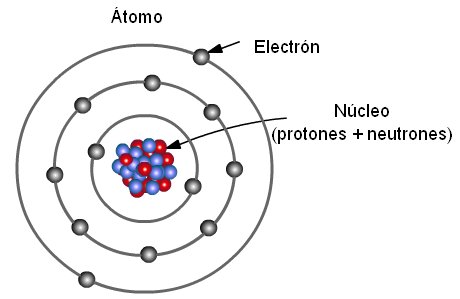
Las relaciones entre los protones y neutrones —presentes en el núcleo del átomo—, y los electrones —ubicados en la corteza o parte externa— fueron motivo de interés para Bohr, quien formuló el primer modelo donde se incluye una cuantización. Este científico intentó incorporar a su modelo la teoría de los cuantos de energía o teoría cuántica que había sido desarrollada por Max Planck en 1900, además de algunos aspectos de la teoría del efecto fotoeléctrico de Albert Einstein, que fue presentada en 1905.
La obra de Bohr es conocida a partir de tres postulados que se pueden expresar básicamente como: 1) Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía; 2) Las únicas órbitas permitidas para un electrón son aquellas en las que el momento angular del electrón sea un múltiplo entero, y 3) El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En ese cambio, emite o absorbe un fotón cuya energía representa la diferencia de energía entre ambos niveles u órbitas.
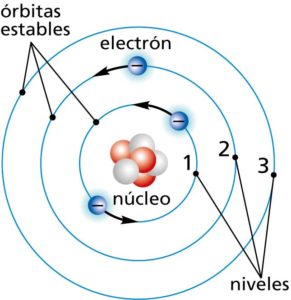
Órbitas cuantificadas
A partir del modelo atómico de Bohr-Rutherford, fue posible la introducción de la teoría de las órbitas cuantificadas, puesto que este modelo perseguía explicar las órbitas circulares estables de los electrones alrededor del núcleo. Según lo propuesto por Bohr, el movimiento de los electrones solo es posible en órbitas específicas o determinadas que se caracterizan por su nivel de energía.
Entre los postulados de Bohr se encuentra que los electrones no orbitan de forma desordenada alrededor del núcleo sino que, por el contrario, este proceso ocurre de forma circular y con distancias fijas bien determinadas.
Dado que cada una de las órbitas genera un tipo de energía, es posible medir la distancia entre el núcleo y las órbitas mediante un número entero o también llamado número cuántico principal —representado con la n—, que puede tener un valor igual o superior a 1. Sin embargo, detalló que los electrones no generan ni absorben energía al girar en torno al átomo sino al saltar espontáneamente de una órbita a otra y estableció que en esos saltos entre las órbitas, los electrones no pasan por órbitas intermedias. Con esta explicación, se determinó que los electrones solo pueden dar saltos cuánticos.
Pérdida o ganancia de energía de los protones
Según el modelo propuesto por Bohr, las órbitas de los átomos solo pueden tener una cantidad de electrones iguales a 2n2, que ascienden en función de su ubicación hacia el exterior del átomo. De esta manera, la cantidad máxima de electrones que pueden tener las primeras cuatro órbitas es 2, 8, 18 y 32. Con este descubrimiento de Bohr, se dedujo que la energía de un electrón es proporcional al radio de la órbita: mientras mayor sea el radio, mayor será la energía. Esto significa que cuando un electrón salta a una órbita superior con respecto al núcleo del átomo, obtiene más energía —ocurre una absorción— y cuando salta a una órbita inferior, la pierde.
La explicación ofrecida en el modelo atómico de Bohr-Rutherford no se queda en la explicación de la pérdida o ganancia de energía electromagnética por el salto de los electrones que orbitan alrededor del núcleo del átomo, sino que también detalla que cuando el electrón pasa a una órbita inferior, la energía perdida es enviada al exterior y es cuando se dice que el electrón desprendió un cuanto de energía o un fotón de luz.
Una de las características de los modelos o representaciones gráficas de los postulados elaborados por los científicos en áreas como la física y la química recae en su caducidad a partir de la comprobación o refutación de sus resultados por otros investigadores, de allí que la propuesta de Bohr fue sustituida en 1916 por el modelo atómico del físico de origen alemán Arnold Sommerfeld.
La diferencia más importante entre los modelos de Niels Bohr y de Arnold Sommerfeld radica en que este último descubrió que las órbitas de los átomos no son circulares sino elípticas. De esta manera, Sommerfeld perfeccionó el modelo de Bohr.
Una de las deficiencias del modelo atómico de Bohr fue que funcionaba muy bien en los átomos de hidrógeno, pero se demostró un error de modelo cuando al analizar los átomos de otros elementos se observaba que los electrones de un mismo nivel energético tenían distinta energía. Al respecto, Sommerfeld concluyó que existían subniveles de energías con ligeras diferencias a lo interno de los niveles energéticos. Desde el punto de vista teórico, Arnold Sommerfeld también descubrió que los electrones en algunos átomos llegan a alcanzar una fracción apreciable de la velocidad de la luz.
¡Por cierto! Antes de que te vayas, queremos recomendarte esto que seguro que te interesa:
- Lisosomas
- Edad Media
- Feudalismo
- Declaración Universal de los Derechos Humanos
- Subrayado
- El Barroco
- Arte Contemporáneo
- Capitalismo
- Batalla de Puebla
Son una serie de contenidos a parte del que has leído que puede ser interesante para tí ¡Muchas gracias por leernos!