Modelo de Rutherford
Desde que Demócrito, filósofo y matemático griego, definió a los átomos como la partículas mínimas e indivisibles de la materia, son varios los modelos teóricos y experimentales que buscan explicar la estructura atómica y su funcionamiento.
Hacer una abstracción lógica de un concepto para convertirlo en una representación gráfica o modelo, ha sido el reto de grandes pensadores en la historia de la investigación científica; de allí que el conocimiento y la estructura de los átomos haya sido un área de interés para la postulación de los llamados modelos atómicos.
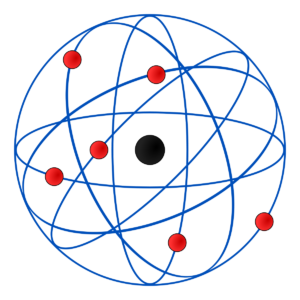
Modelo de Rutherford
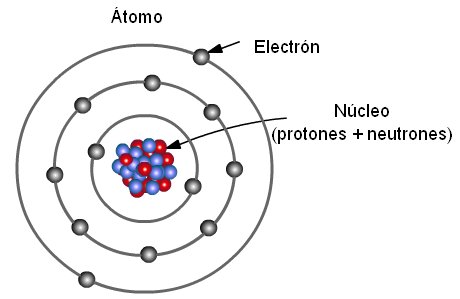
En 1891, el científico Ernest Rutherford descubrió que el átomo tenía una partícula con carga positiva en su interior, a la que denominó protones. Los protones, además de aportar la carga positiva dentro del núcleo del átomo, permiten definir el elemento químico al que pertenece y, a partir de la cantidad de protones existentes en el núcleo, también revela el número atómico, que está representando con la letra Z en la Tabla periódica de los elementos.
El trabajo de Ernest Rutherford
El físico y químico Ernest Rutherford -nacido en la ciudad de Brightwater, Nueva Zelanda, el 30 de agosto de 1871- fue reconocido gracias a sus valiosos aportes en el desarrollo de las llamadas “ciencias exactas”, pero sobre todo por sus descubrimientos en torno a la estructura de los átomos.
Durante buena parte de su vida, Rutherford fue un dedicado profesor, investigador y director del Laboratorio Cavendish de Cambridge. En 1907 también se incorpora como profesor de física en la Universidad de Mánchester.
Los importantes estudios sobre las partículas radioactivas, que logró clasificar en alfa, gamma y beta; lo hicieron merecedor del Premio Nobel de Química en 1908.

Ernest Rutherford
Posteriormente, en 1911, Ernest Rutherford postuló su teoría o modelo atómico, con el que refutó el modelo propuesto en 1904 por el físico británico Joseph John Thomson, a quien se le reconoce también el descubrimiento de los electrones como parte de la estructura del átomo.
Según el modelo atómico de Thomson -también conocido como modelo del pudín de pasas-, los electrones están distribuidos e incrustados uniformemente en el átomo positivo, pero los experimentos de Rutherford logran demostrar una estructura más dinámica de los átomos.
¿Cuáles son los principales postulados del modelo de Rutherford?
Como todo modelo, el planteado por Ernest Rutherford presenta una serie de postulados que reflejan sus principales descubrimientos científicos, sobre todo a partir de experimentos y comprobaciones.
Con la comprobación denominada “el experimento de la lámina de oro”, que incluyó la exposición de una fina lámina de oro con un rayo de partículas alfa que tienen una carga positiva, Rutherford observó que algunas de las partículas alfa presentes en el rayo tenían una deflexión de más de 90 grados.
A partir de su experimento, Rutherford logró hacer deducciones sobre el comportamiento de las trayectorias de los rayos cuando incidían en las láminas y, a partir de esto, sobre la estructura y comportamiento de los átomos.
Uno de los descubrimientos más importantes de Rutherford es la existencia de un núcleo pesado -puesto que contiene casi la totalidad de la masa del átomo- y que concentra la carga positiva en el centro gracias a la presencia de los protones.
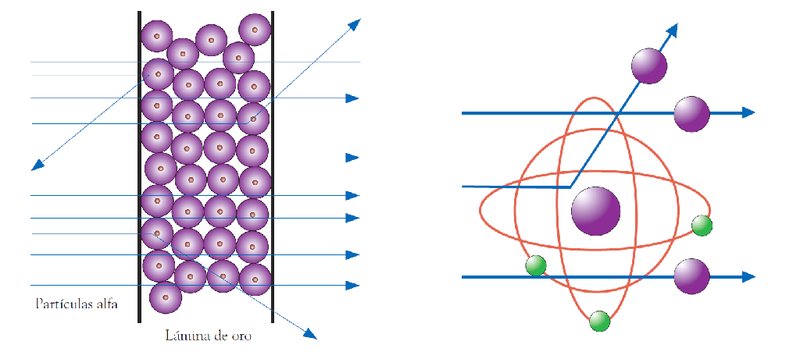
Experimento de la lámina de oro
Otro de los postulados del modelo atómico de Rutherford es que alrededor del núcleo del átomo, los electrones orbitan de forma circular y rápida a grandes distancias del centro. De esta forma, el modelo atómico de Rutherford fue el primero en introducir la referencia del movimiento de los planetas alrededor del sol comparada con el movimiento de los electrones alrededor del núcleo.
Durante el experimento que dio lugar al modelo atómico, Rutherford observó que la mayoría de las partículas alfas atravesaron la fina lámina de oro sin sufrir desviaciones, por lo que dedujo, además, que la mayor parte de la estructura del átomo es hueca y el núcleo es pequeño.
En el modelo atómico de Rutherford se expresa la existencia de una compensación entre la carga de la energía positiva provista por los protones en el núcleo del átomo y la proveniente de los electrones, que es negativa. Asimismo, se plantea que la sumatoria de la carga negativa de los electrones debe ser igual a la carga positiva del núcleo, puesto que el átomo es eléctricamente neutro.
Avances del modelo de Rutherford
Luego de la publicación de sus numerosas investigaciones, Ernest Rutherford fue un gran influyente en el campo de la física nuclear. A partir de la comprobación de su modelo atómico con el “experimento de la lámina de oro”, Rutherford también comenzó a observar que el núcleo del átomo también tendría la presencia de una partícula sin carga o con carga neutra –que más tarde el físico inglés James Chadwick describiría como neutrones-, además de que ya aludía a la existencia de los isótopos del helio y el hidrógeno.
Pero el trabajo de Ernest Rutherford no se agotó en sus propios experimentos y teorías. Con su trabajo y mentoría como director en el Laboratorio de Cavendish en Cambridge, fue posible el descubrimiento de los neutrones por parte de Chadwick, una continuación y mejora de su modelo atómico gracias al modelo atómico propuesto por Niels Bohr, y los importantes hallazgos de Robert Oppenheimer, que lo hicieron convertirse en el “padre de la bomba atómica”.
Precisamente, uno de sus discípulos, el físico Niels Bohr, fue el sucesor del modelo atómico de Rutherford. En 1813 y partiendo de los postulados de Rutherford, Bohr propone un modelo atómico al que también se le conoce como modelo atómico de Bohr-Rutherford, por la importante marca de los aportes de Rutherford en el nuevo modelo.
A pesar del notable trabajo de Rutherford en el descubrimiento y explicación de la estructura y comportamiento de los átomos, el movimiento de las órbitas del átomo plasmado en el modelo atómico de Rutherford contradecía las leyes de electromagnetismo de Maxwell, que ya contaban con una base comprobada a partir de números experimentos científicos y que aplicadas al modelo atómico implicarían la radiación de toda la energía del átomo y la posterior caída de los electrones sobre el núcleo.
¡Por cierto! Antes de que te vayas, queremos recomendarte esto que seguro que te interesa:
- Prehistoria
- Aparato Reproductor Femenino
- Reglas mnemotécnicas
- La Desnutrición
- Feudalismo
- Conocimiento empírico
- La Ilustración
- El Texto Argumentativo
- Selva
Son una serie de contenidos a parte del que has leído que puede ser interesante para tí ¡Muchas gracias por leernos!