Modelo de Dalton
El estudio de la estructura y comportamiento de los átomos dio un vuelco a partir de 1803 cuando John Dalton postuló, por primera vez, una representación gráfica o modelo para explicarlos de forma sencilla. El modelo atómico de Dalton se convirtió así en la primera teoría atómica con base experimental de nuestros tiempos, puesto que las primeras aproximaciones y características del átomo fueron postuladas por el filósofo y matemático griego Demócrito, que vivió entre los años 460 y 370 a.C.
El químico y matemático John Dalton, quien también es reconocido por el descubrimiento de la enfermedad visual conocida como daltonismo, nació el 6 de septiembre de 1766 en la ciudad de Eaglesfield, en Gran Bretaña. Trabajó como profesor de matemáticas y filosofía natural en la llamada Nueva Escuela de Mánchester y fue miembro de la Sociedad Filosófica y Literaria de la misma ciudad.

John Dalton propuso el primer modelo atómico
Además de su interés por la química y la matemática, Dalton mostró gran interés por la meteorología, por lo que en 1793 publicó su primer libro intitulado Observaciones y ensayos meteorológicos. En 1808 publicó su obra Nuevo sistema de filosofía química, en la que desarrolla su teoría atómica.
El modelo atómico de Dalton fue una de sus obras más importantes y sirvió de base para numerosos estudios y experimentos que desencadenaron en avances para la investigación de los átomos y la generación de múltiples explicaciones a los fenómenos en torno a ellos.
Bases del modelo atómico de Dalton
La teoría atómica propuesta por Dalton está basada fundamentalmente en la ley de conservación de masa y la ley de la composición constante. La ley de conservación de masa —propuesta por el químico francés Antoine Laurent Lavoisier— parte de la premisa de que «la materia no se crea ni se destruye, solo se transforma», lo que quiere decir que una reacción química incluye la formación de nuevos productos que tienen propiedades físicas y químicas diferentes a las iniciales.
Por su parte, la ley de la composición constante o también llamada ley de la composición definida —descrita por Louis Proust, químico de origen francés— expresa que la combinación de dos o más elementos para dar como resultado un determinado compuesto ocurre en medio de una relación constante de masas.

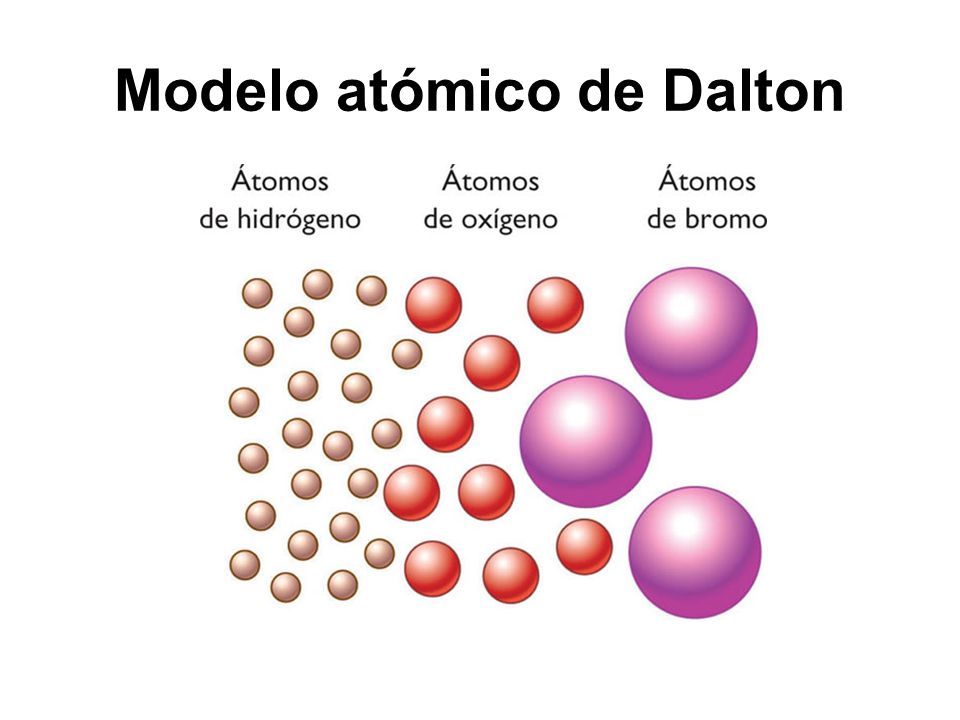
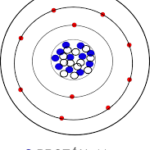
Modelo de Dalton
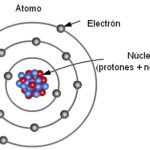
Ante la sencillez de la representación gráfica del modelo de Dalton, es preciso destacar que, debido a la inexistencia de medios y herramientas para hacer experimentos con los átomos en esa época, a Dalton le fue imposible determinar la existencia de una estructura interna de los átomos —dividida en protones, neutrones y electrones, fundamentalmente—, aspecto que fue descubierto por científicos posteriores.
Todo modelo con desarrollo científico requiere de una serie de postulados o propuestas teóricas que generalmente tienen una base experimental comprobada. Es por ello que el modelo atómico de Dalton, además de ser prácticamente pionero en el entendimiento de los átomos, cuenta con seis postulados claves para su desarrollo.
¿Cuáles fueron los postulados de Dalton?
En el primer postulado de su modelo atómico, Dalton coincide con Demócrito al afirmar que el átomo es la partícula mínima e indivisible de la materia, pero que además no puede ser destruida ni modificada sin perder sus propiedades químicas.
El segundo postulado del modelo atómico de Dalton establece que los átomos de un mismo elemento son iguales entre sí, tanto en su masa como en sus propiedades. Este postulado de Dalton permite deducir que los átomos de diferentes elementos también lo son entre sí, distinción que es posible determinar por su peso.
En tercer lugar, el científico John Dalton plantea que la combinación de los átomos permite la formación de compuestos que tienen relaciones simples de números enteros y pequeños. Este postulado expresa que los átomos son indivisibles, pero sí combinables, lo que permite generar compuestos con una mayor complejidad.
En su modelo Atómico, Dalton expresa que es posible combinar átomos de diferentes elementos en proporciones distintas para formar más de un compuesto. Lo que hace posible, además, formar numerosos compuestos a partir del uso de variadas proporciones de los elementos que se dispongan a ser combinados.
En el quinto postulado del modelo atómico de Dalton se establece que la combinación de dos o más elementos de manera constante y sencilla da como resultado un compuesto químico.
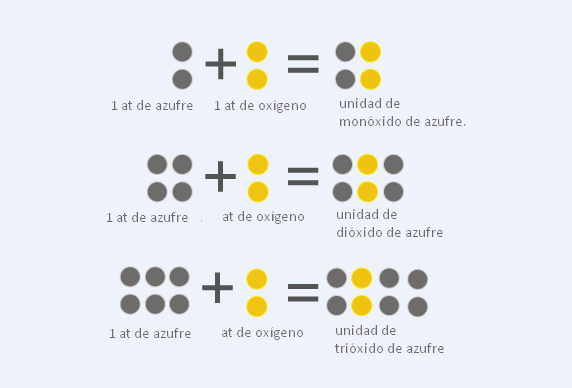
Ley de proporciones múltiples
La trascendencia de la obra de John Dalton es cuantiosa, por cuanto es merecedor de darle fundamento científico a las propuestas de Demócrito y de aplicar a la estructura de los átomos, las teorías y leyes de otros científicos de la época.
El trabajo de Dalton en el entendimiento de la estructura y funcionamiento de los átomos permitió sentar las bases de la química moderna, a la vez que estimuló la generación de una serie de obras que complementarían y trascenderían en la historia de la ciencia y la humanidad.
El modelo atómico de Dalton también permitió generar una serie de planteamientos condensados en la llamada ley de Dalton o ley de las proporciones múltiples. Esta ley fue incluida en el concepto de leyes estequiométricas, que tienen que ver con la relación de la masa de los elementos de un compuesto químico, así como de reactivos y productos disponibles en una reacción química.
La ley de las proporciones múltiples fue formulada y presentada por John Dalton en 1808 y explica —basándose en el quinto postulado de su modelo atómico, que plantea que la combinación de dos o más elementos puede dar lugar a varios compuestos— que la combinación de dos o más elementos que intervienen en un compuesto químico con distintas proporciones dan como resultado que las masas tengan una relación que es expresada a través de números enteros y sencillos.
El sucesor del modelo de Dalton fue el físico de origen británico Joseph John Thomson, a quien se le reconoce el descubrimiento de los electrones y que propuso en 1904 el llamado modelo del pudín de pasas. Según el modelo de Thomson, los electrones o partículas subatómicas con carga eléctrica negativa están distribuidos e incrustados uniformemente –como las pasas en un pudín- en los átomos, que contienen en su núcleo la carga positiva.
¡Por cierto! Antes de que te vayas, queremos recomendarte esto que seguro que te interesa:
- Independencia de México
- Resumen
- Autismo
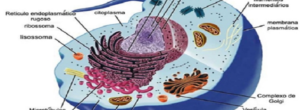
- Lisosomas
- El Cubismo
- Efecto Invernadero
- Las Familias Léxicas
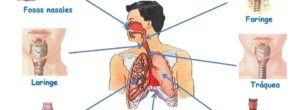
- Sistema Respiratorio
- Abstracto
Son una serie de contenidos a parte del que has leído que puede ser interesante para tí ¡Muchas gracias por leernos!